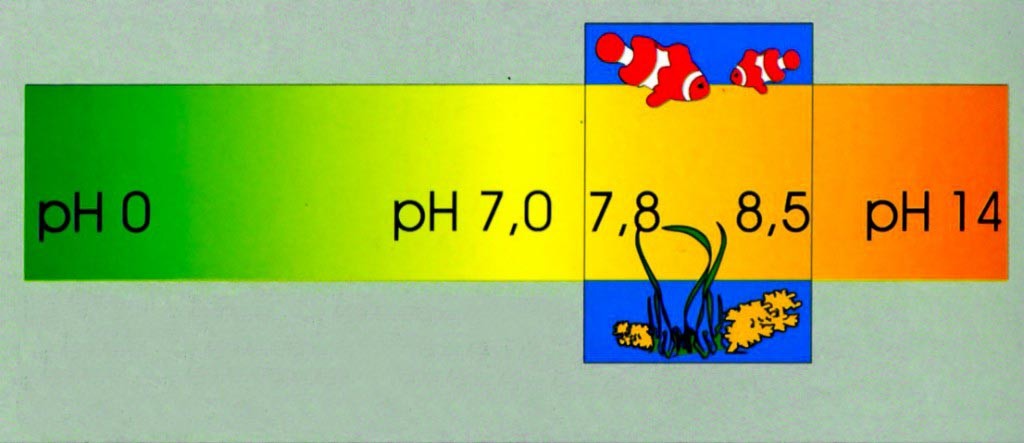
Il valore di pH ci informa dei procedimenti acidi e alcalini in atto in un liquido. In acquario si tratta di un dato molto importante, perché delle variazioni di questo valore conducono a drastici cambiamenti nell’ambiente dei nostri animali. Le sostanze acide riducono il valore di pH e quelle alcaline lo incrementano. La misurazione avviene per mezzo di una scala che va da 0 (acido) a 14 (basico). Il valore intermedio di questa scala, cioè 7,0, indica la neutralità tra acido e basico. Se ad esempio misuriamo oggi nel nostro acquario un valore di pH 7,5, mentre ieri avevamo misurato 8,5, allora questo significa che l’acqua del nostro acquario oggi è dieci volte più acida di quanto era in precedenza. Gli scienziati in questo caso parlano di “decadimento logaritmico negativo”.
Che cosa modifica il valore di pH?
Tutte le sostanze acide che finiscono nel nostro acquario o che vi si sviluppano riducono il valore di pH. Corrispondentemente tutte le sostanze alcaline lo incrementano. Anche in un acquario di barriera che funziona armonicamente, si arriva nel corso del tempo a delle modificazioni del valore di pH. Normalmente la mattina il pH risulta particolarmente basso, mentre durante il giorno aumenta per calare nuovamente durante la notte. Questi cambiamenti si verificano principalmente attraverso diversi contenuti di anidride carbonica dell’acqua. La respirazione degli animali e l’attività dei vegetali, ad esempio delle alghe in un acquario marino, genera CO2, riducendo il pH. La fotosintesi durante il giorno ne determina un notevole consumo, provocando una diminuzione del contenuto acido dell’acqua, e con esso un incremento del valore di pH. Sono normali dei valori verso la fine del periodo di luce di 8,4 o 8,5. Di notte però viene meno l’assunzione di anidride carbonica da parte dei vegetali, e la CO2che si forma si accumula nell’acqua. Infine la domanda decisiva: quante sostanze alcaline ci sono nell’acqua, che in certo modo attendono di legarsi con la CO2e quindi di neutralizzarla, cioè tamponarla? A questo riguardo si devono considerare i carbonati, che possiamo misurare attraverso la durezza carbonatica. Con una durezza carbonatica elevata, cioè con un’acqua relativamente “dura”, ad esempio con 7,0 ° dKH, il nostro acquario potrà assumere CO2fino alla mattina seguente, senza che il valore di pH cali, entrando nell’area di pericolosità al disotto di 7,8. Se la nostra durezza carbonatica però si colloca a valori intorno ad 1 o 2 ° dKH (acqua molto “tenera”), allora non è disponibile una grande riserva tampone alcalina, e correremo il rischio che il valore di pH di notte “crolli verso il basso”. Soprattutto se si pensa che anche durante le attività batteriche di trasformazione delle sostanze organiche, ad esempio delle rimanenze di cibo o degli escrementi degli abitanti dell’acquario, si formano prodotti di metabolismo acidi, che influenzano il contenuto di acidità dell’acqua, diventa chiaro quanto sia importante una sufficiente riserva di tamponi alcalini.
Stabilizzare il valore di pH
Per stabilizzare in acquario il valore di pH, cioè ridurre le fluttuazioni giornaliere, dobbiamo mantenere sufficientemente elevata la riserva tampone alcalina. Questo si può ottenere ad esempio attraverso una regolare sostituzione parziale dell’acqua, circa un dieci percento mensilmente. Una ulteriore possibilità consiste nell’aggiunta mirata di tamponi di durezza carbonatica. In questa maniera rendiamo disponibili delle sostanze alcaline che neutralizzano quelle acide, rendendo così più stabile il valore di pH. Se rimpiazziamo l’acqua evaporata con quella di rete, aggiungiamo ugualmente dei carbonati, e naturalmente anche un reattore di calcio può contribuire ad incrementare la durezza carbonatica del nostro acquario. Tutte queste contromisure vanno in direzione del contenuto di carbonati dell’acqua dell’acquario, ma in questo modo stabilizzano indirettamente anche il valore di pH.